Backwaren & Confiserie: Tipps & Wissen | |||||||
| Backwaren & Confiserie Emulsion mit Casein-Proteinen Emulsions-Stabilität ist eine wichtige Eigenschaft, um in vielen wasser- und gleichzeitig fetthaltigen Lebensmitteln wie Glace, Cremen und Saucen eine genügende Haltbarkeit zu erreichen.
Für die Herstellung vieler Lebensmittel werden Emulgatoren eingesetzt. Milchproteine, die ebenfalls Emulgatoreigenschaften besitzen, haben den Vorteil, dass sie eine natürliche Lebensmittelzutat sind und kein Zusatzstoff. Aus diesen Gründen hat sich die Forschung in den letzten Jahren intensiv mit der Herstellung von stabilen Emulsionen mit Milchproteinen als Emulgator beschäftigt. Die Forschungsanstalt Agroscope Liebefeld-Posieux ALP hat ein Standardverfahren zur Herstellung und Prüfung von Emulsionen mit Caseinaten entwickelt. Eine Emulsion besteht aus einer inneren (dispersen) Phase und einer äusseren Phase (kontinuierliche Phase bzw Dispersionsmittel). Bezeichnet man ein Lebensmittel als Emulsion, kann zwischen Öl-in-Wasser (O/W) Emulsion und Wasser-in-Öl (W/O) Emulsion unterschieden werden. Milch, viele Milchmischgetränke und Desserts auf Milchbasis sind O/W-Emulsionen. Um eine Emulsion zu stabilisieren, werden grenzflächenaktive Substanzen, sogenannte Emulgatoren oder Tenside zugegeben. Dies sind amphiphile Moleküle mit einem fett- und einem wasserlöslichen Teil. Wird ein Tensid in der Lebensmitteltechnologie eingesetzt, so spricht man von einem Emulgator. Die bei der Zerkleinerung der zu verteilenden Tröpfchen entstehende Grenzfläche wird durch den Emulgator dank der Senkung der Grenzflächenspannung stabilisiert. Dadurch verhindert der Emulgator eine Koaleszenz der neu entstandenen Tröpfchen. Dazu muss er möglichst schnell an die bei der Herstellung der Emulsion entstehende Grenzfläche diffundieren. Für Emulgatoren mit geringer Molekulargrösse wie z.B. Monoglyceride von Speisefettsäuren ist dies einfacher und schneller möglich als für grosse Moleküle wie die Milchproteine. Daher sind Emulsionen, hergestellt mit kleinmolekularen Emulgatoren im Emulgierprozess rascher stabilisiert. Grossmolekulare Emulgatoren lagern sich langsamer an die Grenzfläche an und brauchen eine längere Verweilzeit in der Emulgierzone des Prozesses für die Emulsionsstabilisierung.
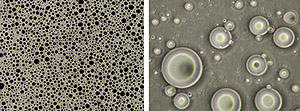
Einmal an der Grenzfläche angelagert bilden die grossmolekularen Emulgatoren, v. a. Proteine, dank Vernetzung untereinander und räumlicher Abstossung zwischen den Tröpfchen stabile Emulsionen. Die Stabilität einer Emulsion variiert zwischen einigen Stunden und einigen Jahren und wird zusätzlich zum Emulgator durch verschiedene Faktoren bestimmt. Je kleiner die Partikel und je enger die Partikelgrössenverteilung, umso stabiler ist eine Emulsion. Eine erhöhte Viskosität der kontinuierlichen Phase wirkt ebenfalls stabilisierend. Weitere Einflussfaktoren sind die Grenzflächenbeschaffenheit und die Art der Ölphase. Die benötigte Menge Emulgator hängt im Wesentlichen von der geforderten Tröpfchengrösse ab. Je kleiner die Tropfen, desto mehr Emulgator wird benötigt. Die Tendenz der feinverteilten Tröpfchen zusammenzufliessen, bleibt dennoch je nach Güte des Emulgators und des angewendeten Emulgierprozesses stärker oder schwächer vorhanden. Emulgiereigenschaften von Milchproteinen Milchproteine werden in der Industrie häufig als Emulgatoren eingesetzt. Proteine haben eine mehr oder weniger flexible Struktur, sind amphiphil, oberflächenaktiv, mehrfach geladen, relativ temperatursensitiv (Molkenproteine) und haben eine starke Oberflächenbindung. Die Unterschiede der Emulsionen sind hauptsächlich auf die Unterschiede in der Struktur und Zusammensetzung der adsorbierten Milchproteine auf der Oberfläche der Fettkügelchen zurückzuführen. Neben der Teilchenstruktur des Emulgators spielen bei der Herstellung von Emulsionen aber auch die Emulgator-Konzentration, der pH-Wert, die Ionenstärke, der Kalziumgehalt, die Gewinnungsart der Proteine sowie die Veränderung der Eigenschaften der eingesetzten Proteine eine Rolle. Die Zutaten des Lebensmittels und die Emulgiertechnik sind weitere zentrale Einflussfaktoren. Emulsionen mit Milchproteinen gelten dann als stabil, wenn das Öl-Protein-Verhältnis ausgeglichen ist und im Dispersionsmittel wenig ungebundenes Protein vorliegt. Vorgänge während der Lagerung Bei einer Emulsion werden die stabile Phase, die Flockenbildung (Aggregation), die Aufrahmung oder Sedimentation und die Koaleszenz unterschieden. Bei der Flockenbildung handelt es sich um eine Aggregation von Tröpfchen ohne eine Veränderung der Tröpfchenoberfläche in bezug auf die Proteinbelegung. Bei der Aufrahmung oder Sedimentation erfolgt die partielle Trennung der emulgierten Phasen auf Grund des Dichteunterschiedes und der Gravitationskraft. Dieser Vorgang ist reversibel. Eine aufgerahmte Emulsion kann meist durch Schütteln redispergiert werden. Koaleszenz ist im Gegensatz dazu ein irreversibler Vorgang. Die Vereinigung der Öltropfen stellt die Vorstufe einer gebrochenen Emulsion dar, bei der sich wässrige Phase und Ölphase weitgehend getrennt haben. Standardrezept und -prozess für O/W-Emulsion mit Caseinat als Emulgator Gegenstand der an ALP durchgeführten Arbeiten war die Festlegung der Bedingungen für eine Standardrezeptur und -prozess zur Herstellung von Emulsionen mit Caseinaten als Emulgator und die Übertragbarkeit der Rezeptur auf andere Milchproteine. Für die Versuche wurde Rapsöl als disperse Phase eingesetzt. Pro Versuchseinheit wurden im Labormassstab 5 kg Emulsion hergestellt. Für die Standardrezeptur wurde zunächst eine 3%-ige Caseinatlösung hergestellt. Dafür wurden 108 g Pulver auf total 3492 g mit Leitungswasser aufgefüllt und mit Hilfe des Ultraturrax T 50 während 3 bis 4 Minuten bei 4000 min-1 aufgelöst und der pH -Wert auf pH 7 eingestellt. Die Lösung wurde während 2 Stunden bei 20°C mit Hilfe des Magnetrührers intensiv gerührt. Der Lösung wurden 1500 g Rapsöl mit dem Ultraturrax (während 10 Minuten) eingerührt. Abbildung: Schema des Standardprozesses. 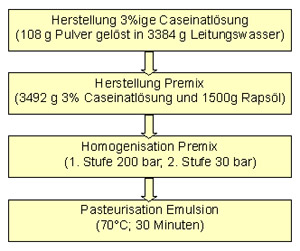 Der Premix (Vorgemisch aus Fett- und Wasserphase) wurde anschliessend auf zwei Stufen in einem Hochdruck-Kolbenhomogenisator homogenisiert. Verglichen mit niedermolekularen Emulgatoren sind Proteine im Reduzieren der Grenzflächenspannung nicht ganz so effektiv. Deshalb wird der Premix unter Hochdruck mit zwei Stufen homogenisiert, damit die Tröpfchen möglichst klein sind und die Proteine genug Zeit haben, sich an die Grenzfläche zu verschieben. Die Emulsion wurde anschliessend bei 70 ºC während 30 Minuten pasteurisiert (siehe Abbildung). Auf ein Konservierungsmittel wurde verzichtet.
Der Premix (Vorgemisch aus Fett- und Wasserphase) wurde anschliessend auf zwei Stufen in einem Hochdruck-Kolbenhomogenisator homogenisiert. Verglichen mit niedermolekularen Emulgatoren sind Proteine im Reduzieren der Grenzflächenspannung nicht ganz so effektiv. Deshalb wird der Premix unter Hochdruck mit zwei Stufen homogenisiert, damit die Tröpfchen möglichst klein sind und die Proteine genug Zeit haben, sich an die Grenzfläche zu verschieben. Die Emulsion wurde anschliessend bei 70 ºC während 30 Minuten pasteurisiert (siehe Abbildung). Auf ein Konservierungsmittel wurde verzichtet. Mit dieser Standardrezeptur konnte eine Emulsion, die mindestens während 3 Wochen Lagerzeit stabil ist, hergestellt werden. Ein Scale-up Versuch vom 5 kg Labormassstab auf die Pilot-Anlagen von ALP (20 kg) war für die definierte Standardrezeptur erfolgreich. Zur Beurteilung der Stabilität der jeweiligen Emulsion, wurde von den hergestellten Emulsionen jeweils die Partikelgrössenverteilung nach 1, 7, 14 und 21 Tagen gemessen sowie der Umfang der Koaleszenz bestimmt. Die Ergebnisse aus der Grenzflächenaktivitätsbestimmung der durchgeführten Versuche zeigten Unterschiede zwischen Caseinaten, Gesamtmilchprotein und reinem Molkenprotein. Reines Molkenprotein wies lediglich eine verminderte Senkung der Grenzflächenspannung sowie eine suboptimale Partikelgrössenverteilung auf. Emulsionen, die mit Molkenproteinen hergestellt wurden präsentierten sich als weniger stabil verglichen mit solchen, die mit Caseinen hergestellt wurden. Der Grund dafür liegt in der Struktur der einzelnen Proteine. Ein weiterer wichtiger Faktor ist aber auch die Gewinnungsart der Proteine. Die durchgeführten Versuche zeigten deutlich, dass Standardrezeptur und -prozess für Caseinate auch auf andere Milchproteine übertragen werden kann. Mit Hilfe der durchgeführten Versuche wurde ein Standardverfahren zur Herstellung von Emulsionen mit Milchproteinen entwickelt. Die Standardrezeptur ermöglicht eine Aussage über die Güte eines Milchproteins in seiner Wirkung als Emulgator. Das Standardverfahren kann in weiteren Schritten auf andere Milchproteine ausgedehnt werden. Interessant dabei wäre, den pH-Bereich der Emulsion durch den Einsatz von (denaturierten) und glykosilierten Molkenproteinen sowie glykosilierten Caseinen als Emulgatoren zu ändern, da sie bei einer Senkung des pH-Wertes unter 4.6 im Gegensatz zu Caseinaten nicht ausfallen. Text und Bilder: Sara Tahajodi, Susanne Marschnig, Dominik Guggisberg, Brita Rehberger, Walter Bisig Schweizerische Hochschule für Landwirtschaft (SHL), 3052 Zollikofen und Forschungsanstalt Agroscope Liebefeld-Posieux ALP, 3003 Bern Weiterlesen: Salatsauce herstellen | |||||||